♡♡ tabla periódica♡♡♡♡
NOMBRE....Tiffany Alexandra Cuaspa Aguilar ♡♡ GRADO...7.1♡
HISTORIA DE LA TABLA PERIODICA
Comienza en la antigüedad, con los presocráticos y los elementos agua, fuego, aire y tierra, pasamos por Platón y Aristóteles quien añade a éstos el éter al que llamó quintaesencia, para llegar a la Alquimia con su gran representante Paracelso, la transmutación y la teoría azufre-mercurio. Se añade un nuevo elemento, la sal y se descubre el zinc.
ROBERT BOYLE escribe “el químico escéptico” donde establece el concepto moderno de “elemento”.
LAVOISIER convierte a la Química en ciencia y hace una primera clasificación. Es el precursor de la Química cuantitativa, emplea la balanza de precisión en el laboratorio por primera vez (grabado de una balanza de la época).
Exponemos facsímil donde aparecen los grabados originales de los instrumentos que utilizaba en su laboratorio.
DALTON le da al átomo un sentido real dotándole de un peso que se podía calcular, queda patente en éste libro de la vitrina 1. Es el primero en estudiar el “daltonismo” que debe su nombre a él mismo. Hemos dispuesto unas gafas de laboratorio antiguas para representar este hecho.
AVOGADRO y su hipótesis.
BERZELIUS hace una clasificación de minerales en cuanto a su composición química. Tenemos los libros donde aparece por primera vez la nomenclatura química por el dispuesta en la que introduce símbolos para denominar los elementos a partir de la primera o dos primeras letras del nombre en latin.
El “azul Thenard o azul cobalto” creado por THENARD
Nos adentramos en el Siglo XIX, siglo de la Ciencia por excelencia, siglo en el que se van a desarrollar gran número de Tablas Periódicas que desembocarán en la actual.
El Congreso de KARLSRUHE en 1860 fue determinante para ello, fue el Primer Congreso Internacional de Química que se celebró, y a él acudieron los científicos más prestigiosos del momento.
Fue organizado por CANNIZZARO, del que tenemos un facsímil de su libro original donde pone orden en la Química. En él se basaron los demás científicos para elaborar sus propias Tablas, entre ellos Meyer y Mendeléiev.
A este Congreso asistió un español, TORRES MUÑOZ LUNA del que tenemos unos libros expuestos.
Hay que hacer alusión a “otras tablas” que precedieron al Congreso.
DÖBEREINER y sus “triadas”, CHANCOURTOIS y su “hélice telúrica”, NEWLANDS y “la ley de octavas”, HINRICHTS y su “espiral”.
ORGANIZACION DE LOS ELEMENTOS EN LA TABLA PERIODICA
DÖBEREINER:
En 1817, este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades. Destaca la
existencia de similitudes entre elementos agrupados en trías que él denomina “tríadas”. Podemos señalar como ejemplo la tríada del cloro, del bromo y del
yodo, que pone en evidencia que la masa de uno de los tres elementos de la tríada es intermedia entre la de los otros dos. En 1850 se pudo contar con unas 20 tríadas para llegar a una primera clasificación coherente.
MEYER:
En 1869, Meyer, químico alemán, muestra una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
MENDELEÏEV:
En 1872, un químico ruso, Dimitri Mendeleiev, ordenó 60 elementos conocidos en la época, en grupos con propiedades similares y los colocó en orden de masa atómica creciente. Actualmente, este ordenamiento de 118 elementos de los 92 son naturales se basa en el NÚMERO ATÓMICO creciente y se conoce como TABLA PERIÓDICA.
En 1869, Mendeleiev, químico ruso, presenta una primera versión de su tabla periódica. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. Se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
Esta tabla fue diseñada para poder mostrar la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente y horizontalmente.
Para poder aplicar la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos.
Estaba convencido de que un día esos lugares vacíos, no lo estarían más. Los descubrimientos futuros confirmaron esta convicción.
Consiguió además prever las propiedades químicas de tres de los elementos que faltaban, a partir de las propiedades de los cuatro elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y germanio, fueron descubiertos y ellos poseían las propiedades que él predijo.
Sin embargo aunque la clasificación de Mendeleiev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica de la época.
Por esto, MOSELEY introdujo, en el año 1913, el siguiente criterio:
"Las propiedades de los elementos son una función periódica de su número atómico. Desde ese entonces los elementos se han ordenado por su números atómicos crecientes, lo cual ha permitido corregir algunos defectos.
Organización de la Tabla Periódica
Para entender cómo se organiza la tabla periódica, imaginemos que escribimos una larga lista horizontal de los elementos en orden de su creciente número atómico. Comenzaría de esta manera:
H Él Li Ser B C N O F Ne Na Mg Al Si P S Cl Ar K Ca...
Ahora bien, si miramos las diversas propiedades físicas y químicas de estos elementos, encontraríamos que sus valores tienden a aumentar o disminuir con Z de una manera que revela un patrón repetitivo, es decir, una periodicidad. Para los elementos enumerados anteriormente, estos descansos se pueden indicar mediante las barras verticales que se muestran aquí en color:
H Él | Li Ser B C N O F Ne | Na Mg Al Si P S Cl Ar | Ca...
Periodos: Para construir la tabla, colocamos cada secuencia en una fila separada, a la que llamamos punto. Las filas están alineadas de tal manera que los elementos de cada columna vertical poseen ciertas similitudes. Así, los primeros elementos de corto período H y He son químicamente similares a los elementos Li y Ne al inicio y al final del segundo período. El primer periodo se divide para colocar H por encima de Li y He por encima de Ne.
La nomenclatura “bloque” mostrada anteriormente se refiere al tipo suborbital (número cuántico l, o clasificación s-p-d-f) de los orbitales de mayor energía que están ocupados en un elemento dado. Para n =1 no hay bloque p, y el bloque s se divide de manera que el helio se coloca en el mismo grupo que los otros gases inertes, a lo que se asemeja químicamente. Para el segundo periodo (n =2) hay un bloque p pero no un bloque d; en la habitual “forma larga” de la tabla periódica se acostumbra dejar un hueco entre estos dos bloques para dar cabida a los d bloques que ocurren en n =3 y superiores. A n =6 introducimos un bloque f, pero para mantener la mesa a dimensiones razonables los bloques f se colocan debajo del cuerpo principal de la tabla.
Grupos: Cada columna de la tabla periódica se conoce como grupo. Los elementos pertenecientes a un grupo dado tienen una fuerte similitud en sus comportamientos químicos.
En el pasado, se utilizaban dos sistemas diferentes de números romanos y letras para denotar los diversos grupos. Los norteamericanos agregaron la letra B para denotar los grupos del bloque d y A para los demás; este es el sistema que se muestra en la tabla anterior. El resto del mundo utilizó A para los elementos d -block y B para los demás. En 1985 se adoptó un nuevo sistema internacional en el que las columnas simplemente se etiquetaban 1-18. Si bien este sistema ha encontrado suficiente resistencia en América del Norte para frenar su incorporación a los libros de texto, parece probable que el sistema “uno a dieciocho” se haga cargo gradualmente.
Familias. Los químicos han encontrado desde hace mucho tiempo conveniente referirse a los elementos de diferentes grupos, y en algunos casos de tramos de grupos por los nombres indicados en la tabla que se muestra a continuación. Los dos de estos que son más importantes para que conozcas son los gases nobles y los metales de transición.
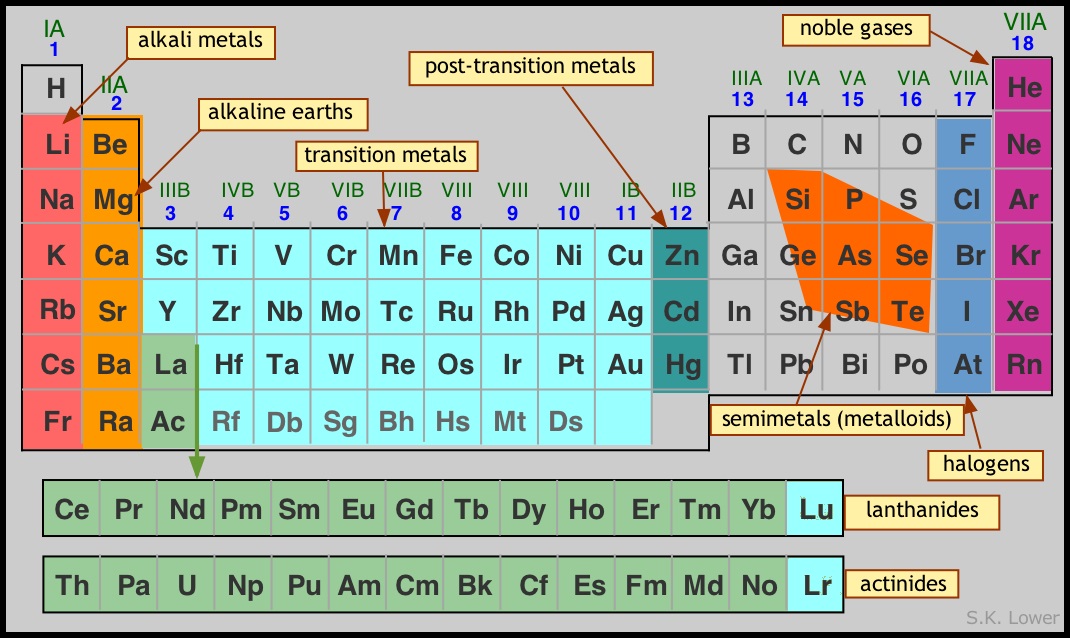
La tabla periódica se organiza en siete filas horizontales, que se llaman periodos, y 18 columnas verticales, que reciben el nombre de grupos. Además, por facilidad de representación, aparecen dos filas horizontales fuera de la tabla que corresponden a elementos que deberían ir en los periodos sexto y séptimo, después del tercer elemento del periodo.
Los grupos con mayor número de elementos son: 1, 2, 13, 14, 15, 16, 17 y 18. Se conocen como grupos principales. Los grupos del 3 al 12 están formados por los llamados elementos de transición, y los elementos que aparecen aparte se conocen como elementos de transición interna. Los elementos de la primera fila de elementos de transición interna se denominan lantánidos, ya que continúan a partir del elemento lantánido con número atómico 57. Los de la segunda fila son actínidos y continúan después del elemento actinio, con número atómico 89.
Observa la siguiente estructura en la imagen:
El número del grupo al que pertenece un elemento coincide con sus electrones de valencia (de dos dígitos, corresponde al segundo dígito).
Una de las ventajas de la tabla periódica es que permite predecir las propiedades de los elementos con sólo ver su posición dentro de ella. Además permite realizar comparaciones entre diferentes propiedades de los elementos, a las cuales se les conoce como propiedades periódicas.
PROPIEDADES PERIODICAS Y SU PERIODICIDAD.....
Radio atómico
El tamaño de un átomo no es invariable: depende del entorno inmediato en el que se encuentre, así como de su interacción con los átomos vecinos. El radio atómico de un elemento es la mitad de la distancia entre los centros de dos átomos vecinos. Se miden en angstroms Å (1 Å = 1x10-10 m) o nanómetros nm (1 nm = 1 x 10 m). Los átomos de los distintos elementos varían mucho en tamaño. Por ejemplo, el radio del átomo del rubidio es de 2.50 Å. Casi 4 veces más grande que el del átomo de flúor (0.64 Å).
En términos generales, a lo largo de un grupo, el radio atómico aumenta de arriba hacia abajo debido a que el número de electrones que se debe acomodar es mayor y recuerda que hay un número máximo de electrones para cada nivel de energía. Por ello, se requiere un mayor número de niveles, lo que provoca que los últimos electrones que se acomodan estén más alejados del núcleo. A diferencia de los grupos, al avanzar en un periodo, disminuye el valor de los radios atómicos de izquierda a derecha. La explicación es la siguiente: el nivel en el que se van acomodando los electrones es el mismo, pero la carga positiva del núcleo aumenta, lo que hace que los electrones se acerquen más al núcleo, y disminuyendo así el radio.
Energía de ionización
Es la energía necesaria para separar el electrón externo de un átomo neutro en estado gaseoso. Depende de la distancia entre el electrón y el núcleo, es decir que entre más alejado esté el electrón del núcleo, menos atracción ejercerá este último sobre él y viceversa, entre más cerca esté el electrón del núcleo más energía requerirá para que se separe, ya que hay mayor atracción entre ellos. Como verás, esta propiedad está relacionada con el radio atómico.
Dentro de un mismo grupo, la energía de ionización disminuye de arriba hacia abajo y esto se debe a que conforme descendemos en la tabla periódica, los átomos tienen más electrones, lo que hace que disminuya la atracción del núcleo sobre el electrón más externo. En un mismo periodo la energía de ionización aumenta de izquierda a derecha, debido a que su radio atómico disminuye. El electrón externo del átomo está menos alejado del núcleo y por tanto la fuerza con la cual es atraído aumenta.


Comentarios
Publicar un comentario